Препарат от рака и запах древних цветов: что такое синтетическая биология

От неоднозначных изобретений вроде «золотого риса» и генно-модифицированных эмбрионов человека до лекарства от рака и аромата вымерших цветов: рассказываем, как ученые создают с нуля и «переписывают» гены.
Что такое синтетическая биология
Синтетическая биология — это быстроразвивающаяся область науки, включающая в себя биотехнологии, генную инженерию, молекулярную биологию и многое другое. С ее помощью ученые манипулируют генами и геномом (совокупностью всей наследственной информации клетки), создавая новые биологические системы.
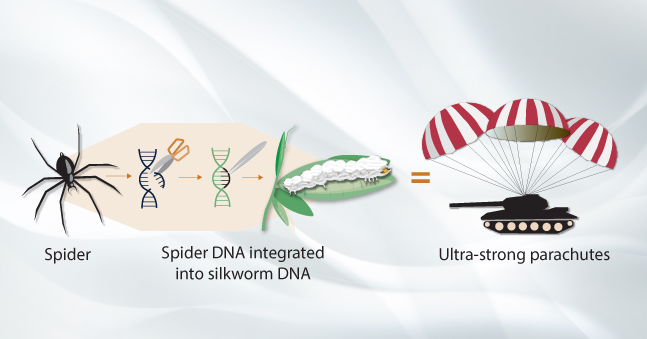
При помощи этого научного направления с чистого листа, молекула за молекулой, ученые производят усовершенствованные лекарства, топливо, ткани, продукты питания и ароматы. Изменению поддаются не только целые биологические системы, но и функционал отдельной клетки — то, на чем она специализируется. Исследователи редактируют генетический материал вирусов, бактерий, дрожжей, растений и животных для придания им новых полезных свойств. Например, интегрируют участки ДНК паука в геном клетки шелкопряда, что заставляет последнего производить прочный и легкий паучий шелк. Искусственно создавая колонии трансгенных гусениц, исследователи получают нити, достигающие 80% прочности паутины и сравнимые по надежности с кевларом (материалом, из разных видов которого изготавливаются бронежилеты, лыжи, теннисные ракетки, детали автомобилей и космических кораблей). «Мы можем смешивать гены, как краски в палитре, — отмечает один из авторов проекта, молекулярный биолог Малькольм Фрейзер из Нотр-Дамского университета. — Мы берем гены, кодирующие необходимые свойства, комбинируем их, и все они проявляются в полученных волокнах». Синтетический материал планируют использовать для создания сверхпрочных военных парашютов, бронежилетов, хирургических нитей и т.д.
Когда появилась синтетическая биология
Впервые термин «синтетическая биология» (synthetic biology) предложила немецкий биохимик Барбара Хобом в 1980 году. С его помощью ученая описала бактерию, полученную через рекомбинацию ДНК (искусственное создание цепи ДНК, включающей в себя разнородные последовательности генов). Впоследствии термин редко употреблялся в научном сообществе за исключением отдельных исследований середины 1990-х.
Повторное осмысление понятия произошло спустя десять лет. В 2000 году американский химик Эрик Кулл вместе с коллегами использовал термин в своем докладе на ежегодном собрании Американского химического общества в Сан-Франциско.
Наконец, в 2010 году на свет появилась первая «гражданка мира синтетической биологии» — жизнеспособная бактерия с полностью искусственным геномом Mycoplasma mycoides JCVI-syn1.0, или «Синтия». Американский биотехнолог Дж. Крейг Вентер вместе с коллегами пересадил геном Mycoplasma mycoides длиной около 1,1 млн пар нуклеотидов (структурной единицы ДНК) в клетки бактерии Mycoplasma capricolum. Трансплантация была успешной: довольно скоро клетка-реципиент (M. capricolum) начала проявлять физические характеристики своего хромосомного донора (M. mycoides), и бактерию отнесли в конечном счете к виду микоплазма микоиды (M. mycoides). На разработку технологии, необходимой для такой пересадки, ушло 15 лет.
Как работает синтетическая биология
Синтетическая биология применяет несколько инженерных принципов для разработки новых и перепрограммирования уже имеющихся биологических систем. Среди них можно выделить:
-
абстракцию
С помощью этого принципа исследователи адаптируют биологические системы под свои нужды. Ведь из-за сложности устройства этих систем их трудно воссоздавать в лабораторных условиях. Упростив их, ученые получают возможность быстрее разрабатывать эти системы in vitro. Облегченная информация распределяется по нескольким уровням иерархии. Например, по структурным уровням организации живого, переходя от простого к сложному: от ДНК — к клетке — к тканям — к организму в целом. Исследования на каждом уровне производятся независимо друг от друга. Такой подход помогает преодолеть цель по воспроизведению биосистем, «раздробив» ее на несколько задач поменьше;
-
модульность
Подобно игрушечным строительным блокам модульное проектирование в синтетической биологии позволяет легко комбинировать и оптимизировать элементы живого, или биодетали. Принцип модульности был реализован и до лабораторных экспериментов. К модулеподобным подсистемам организма генетики относят симбиозы между живыми существами, например, мутуализм кораллового полипа актинии и рыбы-клоуна.
Для более эффективной работы с биодеталями в 2003 году ученые из MIT создали банк BioBrick, в котором собрано уже более 20 тыс. биологических образцов (последовательностей ДНК, белков, рецепторов и др). Данные постоянно дополняются участниками конкурса по синтетической биологии iGEM;
-
стандартизацию
Синтетическая биология стремится разработать универсальные и ясные в использовании протоколы, принять единые стандарты работы с данными. Чтобы ускорить обмен информацией, генетики разработали стандарт передачи данных по синтетической биологии — Synthetic Biology Open Language (SBOL). Данные в SBOL записываются на различных языках программирования — от C++ и Java до Python.
Другой прорывной шаг в оптимизации работы состоял в организации облачных лабораторий. Например, лаборатория Emerald Cloud Lab предлагает избавить «мокрых» биологов (исследователей, проводящих эксперименты в лабораториях) от ручного труда. С помощью цифровой лаборатории ученый выбирает один из протоколов на сайте организации и задает алгоритм манипуляций с образцами. После этого роботизированная техника проходится по всем шагам протокола, проводя эксперимент, а ученому остается лишь интерпретировать данные.
Как ученые редактируют гены
Одним из наиболее востребованных редактирующих инструментов последнего времени стала технология, основанная на иммунной системе бактерий и архей — CRISPR-Cas9. За ее разработку ученые Эмманюэль Шарпантье и Дженнифер Даудна получили Нобелевскую премию по химии 2020 года.
Эта технология включает в себя работу двух блоков иммунной системы бактерий — CRISPR и Cas. Первый блок отвечает за особые участки на бактериальной ДНК, которые называются короткими палиндромными кластерными повторами, или CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats). Эти повторы одинаковы и распределяются между уникальными фрагментами ДНК — спейсерами (от англ. spacer — «разделитель»). На спейсерах «записываются» фрагменты генетической информации вирусов и других чужеродных элементов, атакующих клетку бактерии. Устройство системы CRISPR чем-то похоже на библиотеку: спейсеры — это книги со всей необходимой информацией, а повторяющиеся CRISPR — полки, благодаря которым книги находятся на нужном месте. Спейсеры совместно с CRISPR формируют CRISPR-массивы. В конечном счете, с помощью записанной на этих массивах генетической информации и формируется иммунная память бактерии.
В 2002 году рядом с CRISPR-массивами у всех бактерий нашли ферменты Cas (CRISPR-Associated Sequence). Разновидность этого фермента — Cas9 — распознает и расщепляет участок ДНК, который требует замещения. Фермент делает это не в одиночку, а с помощью направляющей РНК, которая и указывает на специфический сегмент в ДНК. Cas9 действует как «молекулярные ножницы»: он разрезает ДНК в необходимом месте и уничтожает информацию о вирусе, защищая клетку от инфекции. После того как Cas9 разделил участок ДНК, запускается система репарации (восстановления) клетки. При этом реализуется один из двух вариантов развития событий. В первом случае происходит устранение поломки с помощью гомологичной рекомбинации, в ходе которой биотехнологи внедряют нужную последовательность ДНК в исследуемый участок. В противном случае может произойти негомологичное соединение концов, что приводит к нарушениям в структуре и работе функциональных элементов генома.
Ученые показали, что системы CRISPR-Cas функционируют не только в бактериях и археях, но также и в клетках высших организмов. И стало понятно, что с помощью этой технологии можно редактировать и геном животных.
Система CRISPR-Cas9 вызвала большой ажиотаж в научном сообществе, поскольку она быстрее, дешевле и точнее предшествующих методов редактирования генома. Сейчас технологию используют в генной терапии для нокаутирования (выключения) или редактирования «сломанных» генов. Это позволяет использовать CRISPR-Cas9 для борьбы со многими генетически обусловленными болезнями. Так, в 2016 году группа китайских генетиков под руководством онколога Лу Ю из Сычуаньского университета ввела модифицированные с помощью технологии CRISPR-Cas9 клетки пациенту с агрессивным раком легких. В иммунных клетках крови пациента был выключен ген, кодирующий необходимые для деления раковых клеток белки. По состоянию на 2020 год эта процедура привела к замедлению роста агрессивной опухоли.
Предполагается, что в недалеком будущем с помощью CRISPR-Cas-системы можно будет лечить моногенные заболевания, такие как гемофилия, муковисцидоз, лейкемия.
Какие задачи ставит перед собой синтетическая биология
Синтетическая биология стремится решать проблемы современной медицины, сельского хозяйства, производства и окружающей среды. Например, в системе здравоохранения ее результаты можно применять для создания новых методов лечения. В частности, для разработки лекарств с наименьшими побочными эффектами, которые возникают, если лекарство связывается с большим количеством различных клеток и белков в организме. Синтетическая биология потенциально может помочь в разработке лекарства с узконаправленным эффектом, прицельно уничтожающим очаг заболевания.
Ученые также изучают возможности использования синтетической биологии для решения проблем окружающей среды, создания экологически чистых технологий. Так, британские биологи разработали технологию по повышению роста сельскохозяйственных культур. Команда микробиологов под руководством профессора Лунинга Лю из Ливерпульского университета использовала методы синтетической биологии и инженерии растений для улучшения фотосинтеза у растений. Фотосинтез — это сложный химический процесс преобразования энергии Солнца в энергию органических веществ. Он необходим для существования всех живых организмов, населяющих Землю. Чтобы повысить способность некоторых растений к фотосинтезу, британские ученые отредактировали рубиско табака — фермент, с помощью которого запускается реакция преобразования CO2 в энергию. Команда исследователей пришла к выводу, что генно-модифицированный рубиско улучшает способность растений превращать углекислый газ в энергию.
Как синтетическая биология применяется прямо сейчас
С помощью синтетической биологии исследователи стараются минимизировать вредные для окружающей среды методы ведения сельского хозяйства. Например, биоинженерные технологии позволяют производить спреи для более эффективной борьбы с насекомыми-вредителями, а также искусственно сдерживать рост популяции определенных видов насекомых через редактирование их генома.
Вот некоторые примеры того, как ученые используют инструменты синтетической биологии прямо сейчас.
-
Препарат от рака
Лекарство от швейцарской компании Novartis под названием Kymriah было одобрено Управлением по контролю за продуктами и лекарствами США (FDA) в 2017 году. А весной 2023 года средство прошло проверку и Минздрава России. Kymriah используется для лечения В-клеточного острого лимфобластного лейкоза (ОЛЛ), самого распространенного вида рака у детей. Опухоль поражает В-лимфоциты иммунной системы человека. Для борьбы с болезнью ученые модифицируют собственные иммунные клетки организма. Лечение включает в себя генетическое редактирование Т-лимфоцитов пациента для экспрессии (преобразования) химерного антигенного рецептора (CAR). CAR — это белок с антителом, распознающим белок CD19. Это антитело присутствует на злокачественных В-клетках. Модифицированные клетки CAR-T могут распознавать раковые клетки как злокачественные и помогать уничтожать эти ткани иммунной системой самого пациента.
-
Аромат цветов, вымерших более века назад
Биоинженеры из американской компании Ginkgo Bioworks разработали дрожжи, с помощью которых воссоздали ароматы давно исчезнувших цветов. Ученые сосредоточили внимание на трех растениях — Гибискадельфусе вильдериевом (Hibiscadelphus wilderianus), Orbexilum stipulatum и Леукадендроне крупноцветковом (Leucadendron grandiflorum).
Первый цветок из списка, камнеломка Hibiscadelphus wilderianus, росла на древних лавовых полях, на Гавайях. Ее среда обитания была уничтожена колониальным скотоводством. Последнее упоминание камнеломки датируется 1912 годом. Orbexilum stipulatum в последний раз видели в 1881 году на острове Рок-Айленд, штат Кентукки. А Leucadendron grandiflorum — в 1805 году. В 2019 году Ginkgo Bioworks организовали выставку «Возрождение запаха вымерших растений» (Reviving the Smell of Extinct Plants), где показывали воссозданные образцы.
-
Вакцины на генно-модифицированной основе
Синтетическая биология также помогает быстро разрабатывать вакцины против многих болезней: от свиного гриппа A (H1N1) до коронавируса и оспы обезьян. В случае с A (H1N1) и SARS-CoV-2 разработка вакцин проводилась с использованием генно-модифицированной мРНК. Матричная РНК содержит информацию о структуре белков клетки и при переносе генетической информации с ДНК на РНК матричная РНК используется как шаблон (матрица) для синтеза белков. С помощью технологий синтетической биологии ученые воспроизвели мРНК вирусов и на ее основе разработали вакцины. Для разработки вакцины от оспы обезьян был получен генно-модифицированный штамм Saccharomyces cerevisiae VL6-48B, на котором был, в свою очередь, собран геномный фрагмент вируса оспы обезьян.
Однако не всегда изобретения синтетической биологии можно однозначно причислить к полезным разработкам. К неоднозначным решениям можно отнести, например, историю с генно-модифицированным рисом, который был разработан для устранения дефицита витамина А.
Дефицит витамина А ежегодно вызывает слепоту у 250–500 тыс. детей и значительно повышает риск смерти ребенка от инфекционных заболеваний. В 2009 году группа американских ученых опубликовала статью, в которой поделилась результатами по разработке генно-модифицированного «золотого риса». Исследователи утверждали, что его употребление устраняет дефицит витамина А. В июле 2021 года Филиппины стали первой страной, выдавшей официальное разрешение на коммерческое распространение «золотого риса» в Юго-Восточной Азии. Правда, уже в апреле 2023 года Верховный суд страны приказал Департаменту сельского хозяйства Филиппин прекратить коммерческое разведение риса из-за петиции MASIPAG, поданной группой фермеров и ученых. Последние утверждали, что генно-модифицированный рис нельзя считать безопасным, так как требуется провести дополнительные исследования и провести независимую оценку рисков. По решению Верховного суда коммерческое выращивание «золотого риса» было отменено.
Еще один неоднозначный результат деятельности ученых на поприще синтетической биологии — это работа китайского генетика Хэ Цзяньку по редактированию гена человека. Ученый с помощью технологии CRISPR-Cas9 изменил ген CCR5 у близнецов-эмбрионов, после чего в 2018 году на свет появились девочки-близнецы Лулу и Нана с врожденным иммунитетом к ВИЧ-инфекции. А через год, согласно заявлению Государственного информационного агентства Синьхуа, на свет появился еще один генно-модифицированный ребенок, имя которого держится в секрете.
Деятельность ученого вызвала неоднозначную реакцию коллег и критику со стороны общественности. И в 2018 году Национальная комиссия по здравоохранению Китая начала проверку в отношении Хэ Цзяньку. В 2019 году суд китайского города Шэньчжэнь приговорил ученого к трем годам тюрьмы и штрафу в $430 тыс. Сейчас опальный ученый уже на свободе. В недавнем интервью он рассказал, что у детей с отредактированными генами «нормальная, мирная и спокойная жизнь». Хэ Цзяньку также утверждает, что открыл новую лабораторию Jiankui He Lab для разработки лекарства от мышечной дистрофии Дюшенна (МДД).
Насколько перспективен рынок
Стартапы в области синтетической биологии привлекают все больше средств. Так, за первую половину 2020 года в эту область было вложено около $3 млрд. В числе успешных кейсов — стартап Impossible Foods, который использует биоинжиниринг для производства растительного мяса. С 2019 по 2023 год доходы компании выросли с $90 млн до $370 млн. А вся компания, согласно последним данным, оценивается в $10 млрд.
В целом, по данным отчета McKinsey, рынок синтетической биологии может привнести в глобальную экономику до $4 трлн в течение следующих 10–20 лет.
Это связано с тем, что более 60% биологических материалов, которые используются как ресурсы в мировой экономике, могут быть заменены на генно-модифицированные аналоги. И даже скромный прогресс в этом направлении может значительно повлиять на международную экономику, общество и нашу жизнь, включая привычки в питании, медобслуживании и использовании ресурсов.
Источник: https://trends.rbc.ru/trends/industry/
